Autor: Alberto Armocida MSC MV (Vetanco SA)
Hasta el momento, se han identificado en cerdos, la presencia de 4 especies del género Circovirus, incluyendo al:
- Circovirus porcino 1 no patógeno (PCV1), que contamina los cultivos celulares.
- Circovirus porcino 2 patógeno (PCV2).
- Circovirus porcino 3 (PCV3) patógeno descripto en los últimos años en procesos clínicos de dermatitis/nefropatía, fallas reproductivas y miocarditis en fetos abortados, donde aún no se establece claramente su interrelación con los síndromes producidas por el PCV2 (Palinski R. y col., 2016, Arruda B. y col., 2019, Segales J. y col., 2019).
- Circovirus porcino 4 (PCV4), este virus fue identificado en cerdos domésticos de la provincia de Hunan, China, sin embargo, este último hallazgo deberá ser sometido a futuros estudios para determinar su patogenia e implicancia clínica en el cerdo doméstico (Zhang H. y col., 2019).
Enfermedades asociadas al PCV2
Al conjunto de enfermedades asociadas a la infección por PCV2 se las denominó en Norteamérica PCV2-AD (del inglés PCV2-AD associated diseases) o PCV2-D en Europa (del inglés PCV2-Diseases -enfermedades- producidas por PCV2). Finalmente se retiene el término de PCV2-D. (Segales J., y col., 2019, Lopez-Soria S. y col., 2016).
PCV2-D posee al menos 4 diferentes manifestaciones clínicas (Segales J. y col., 2019, Segales J. y col., 2012, Lopez-Soria S. y col., 2016).
1. La Circovirosis Porcina es una enfermedad muy expandida y presente en todo el mundo y es conocida como SMAP: Síndrome Multisistémico de Adelgazamiento Post-destete (del inglés: PMWS: Post weaning multisystemic wasting síndrome), hoy denominada como: Enfermedades sistémicas asociadas al PCV2: ES-PCV2 (del inglés PCV-2 systemic diseases: PCV2-SD) (Lopez-Soria S. y col., 2016, Segales J. y col., 2019). Dentro de las manifestaciones descriptas en PCV2-SD, encontramos también los cuadros de neumonía intersticial y enteritis granulomatosa (Segales J., y col. 2019).
2. Enfermedad subclínica asociada a la infección por PCV2-SI (del inglés-PCV2-SI subclinical infection) (Segales J., y col. 2012).
3.-PCV2-RD: Enfermedad reproductiva asociada a la infección por PCV2 (del inglés PCV2-RD reproductive diseases).
4.-SDNP: Síndrome de Dermatitis y Nefropatía Porcino.
PCV2-SD:
Se trata de una enfermedad multifactorial que se presenta en cerdos de recría y engorde donde su presentación está condicionada por la infección con PCV2, y la influencia de otros factores infecciosos y no infecciosos (Lopez-Soria S. y col., 2016).
Su presentación clínico-patológica bien florida y su impacto en la producción porcina, alcanzó su máxima expresión a fines de los años 90 e inició de los 2000.
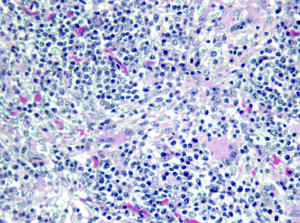
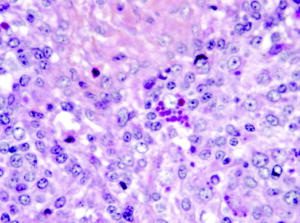
Se caracteriza clínicamente, principalmente, por el desmedro progresivo (Imagen N°1), palidez y aumento del tamaño de los ganglios linfáticos (inguinales). Microscópicamente se observa: Depleción linfoide, infiltración de células histiocitarias y células gigantes multinucleadas (Imagen N°2), presencia de cuerpos de inclusión intracitoplasmáticos en forma de “racimo” (Imagen N°3).
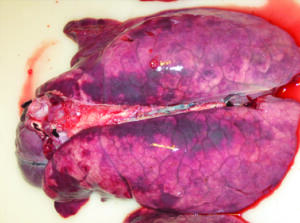
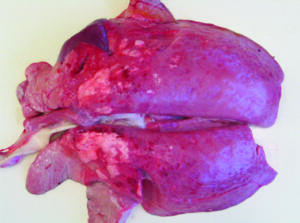
Las manifestaciones respiratorias y digestivas, como edema y neumonía intersticial (Imagen N°4) y enteritis granulomatosa, respectivamente, son cuadros frecuentes de ver en granjas afectadas por PCV2 y hoy consideradas dentro de las manifestaciones de PCV-SD (Segales J. y col., 2019). Estas neumonías intersticiales pueden ser también producidas por infecciones simples de PCV2 (Imagen N°4) o mixtas con otros agentes: PCV2 más PRRS, SIV, Mhyo, App…, formando parte del complejo respiratorio infeccioso porcino (Imagen N°5) (Martineau G-P. y col., 2010).
PCV2-SI: En esta forma, las manifestaciones clínicas de desmedro son más sutiles, presentándose como una disminución de la ganancia diaria, histológicamente las lesiones son muy leves y no siempre se pone en evidencia el virus en los tejidos (Segales J. y col., 2012).
PCV2-RD: Se caracteriza por abortos y momias en el final de gestación, retornos al celo, lesiones de miocarditis y presencia de virus en los corazones de fetos abortados (Segales J. y col., 2012). Se vincula al PCV2-ER con el conocido y ya poco mencionado Síndrome de
SMEDI (S-stillbirth-nacidos muertos, M-mummification-momificación, ED-embryonic death-muerte embrionaria e I-infertility-infertilidad) (Lopez-Soria S. et col., 2016, Meyns T. y col., 2012).
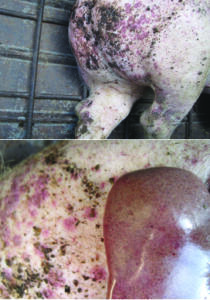
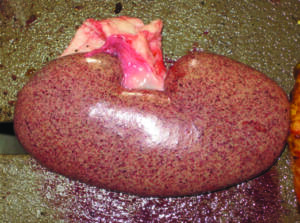
SDNP: Es una enfermedad que se manifiesta principalmente en cerdos de engorde y terminación con baja morbilidad y alta letalidad. Las lesiones bien características de maculas y pápulas en la piel, principalmente de la región perineal y cuartos traseros (Imagen N°6), están asociadas a una severa y mortal glomerulonefritis (Imagen N°7). SDNP es una enfermedad mediada por inmunocomplejos produciendo vasculitis fibrinoide y necrotizante sistémica. (Segales J. y col., 2007, Segales J., 2014).
Hoy en día se sigue asociando a la SDNP con la infección de PCV2, si bien no se determinó exactamente su etiología (Segales J. y col., 2019). En ese sentido se describen altos títulos en suero de Ac anti PCV2 en animales con SDNP, comparados con animales sin clínica y aquellos con manifestaciones de PCV2-SD (Iowa State University 2016, Segales J. y col., 2007, Segales J., 2014).
SDNP y fallas reproductivas también es asociado a la infección por PCV3 (Pyñeyro P. y col., 2018, Palinski et al, 2016). Siendo los dos síndromes: SDNP y fallas reproductivas descriptos en infecciones por PCV2 y PCV3. El equipo de Iowa State University, definen en USA una entidad que denominan: Enfermedades asociadas a la infección por PCV3 (PCV3-AD del inglés Associated Diseases), caracterizada por la manifestación de: Síndrome de dermatitis y nefropatía (SDNP), fallas reproductivas, encefalitis y miocarditis en lechones muertos en periparto, así como periarteritis (vasculitis) sistémica. (Iowa State University, 2016., Arruda B y col., 2019).
Agente etiológico PCV2:
El Circovirus Porcino tipo 2: PCV2 es un virus muy pequeño desnudo, El ADN es una cadena simple circular que posee 1767-1768 nucleótidos. Estos nucleótidos se disponen en, al menos, 11 marcos abiertos de lectura “ORF” (del inglés Open Reading Frame) pero solo 4 ORFs expresarían proteínas (Segales J. y col., 2019). ORF1: Esta porción codifica proteínas no estructurales de tipo replicasa (Rep gen), la ORF2 codifica la proteína estructural de la cápside (Cap gen), la cual tiene propiedades inmunogénicas induciendo respuesta humoral y celular. La ORF3 y la ORF4 codifican proteínas no estructurales con funciones in vitro relacionadas con la regulación de los linfocitos T. También se asocia a la ORF3 con el grado de patogenicidad del virus (Segales J. y col., 2019).
En función de la secuencia de la ORF2 se identificaron varios genotipos de PCV2 hasta ahora denominados como: PCV2a, PCV2b, PCV2c, PCV2d, PCV2e, PCV2f, PCV2g y PCV2h, muchos de ellos descriptos al inicio en China y luego en el resto del mundo (Franzo G. y col., 2018. Yao J. y col., 2019).
El PCV2a es el genotipo descripto en los primeros casos de alta prevalencia que sucedían en los años 1996 al 2000. El PCV2b con gran prevalencia, es descripto posteriormente en la mayoría de los países: Europa, USA (Franzo G y col., 2018), Argentina (Capuccio J. y col., 2016), Chile (Neira V. y col., 2017), Colombia (Monroy M y col., 2014) y otros países.
Si bien el PCV2a y PCV2b pueden reproducir experimentalmente el PCV2-SD, el PCV2b se lo asocia a manifestaciones clínicas más severas (Lopez-Soria S. y col., 2016).
El PCV2c también es capaz de producir PCV2-SD y la severidad de sus signos clínicos serían similares a los producidos por los genotipos PCv2a y PCV2b (Segales J. y col., 2019).
El PCV2d mutante del PCV2b se encontró en China y ahora en el mundo entero, como Argentina, Colombia, Chile y otros. (Franzo G y col., 2018. Capuccio J. y col., 2016. Neira V. y col., 2017. Monroy M y col., 2014).
El PCV2c se describió en material de archivo en cerdos de Dinamarca -antes de la aparición de los genotipos PCV2a y PCV2b- (Dupont K. y col., 2008), en jabalíes de Brasil y en cerdos domésticos de China (Segales J. y col., 2019) y el PCV2e se presentan en USA y México. No está bien definida la significancia clínica del PCV2e (Segales J. y col., 2019).
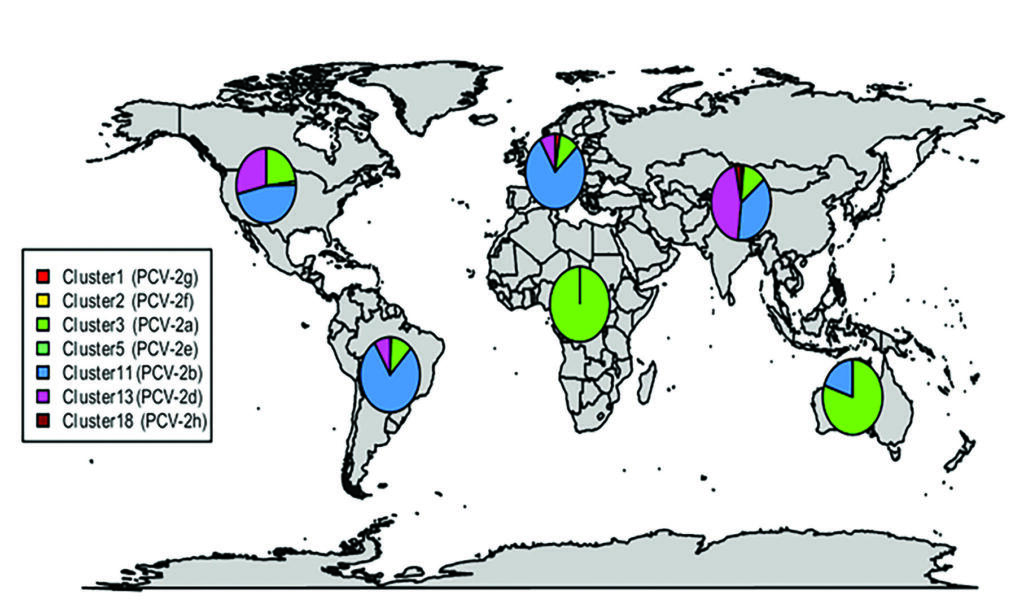
La distribución y predominancia mundial de los diferentes genotipos de PCV2, es bien representada en el mapa adjunto (Franzo G. y col., 2018).
Transmisión:
El PCV2 se encuentra en todas los fluidos corporales y tejidos (nasales, bucales, bronquiales, materia fecal, orina, leche, semen…).
La vía de transmisión más importante es la oronasal mediante el contacto directo (Lopez-Soria S. y col., 2016). El semen puede infectar y producir una enfermedad reproductiva en una cerda inseminada con semen contaminado con PCV2. Por otro lado, el PCV2 puede atravesar la placenta de una hembra gestante contaminada con PCV2 vía nasal y producir lechones nacidos infectados y abortos (Lopez-Soria S. y col., 2016. Park J. y col., 2005. Madson D. y col., 2009b).
La participación del PCV2 en los problemas reproductivos sigue siendo difícil de dimensionar, al igual que otras causas infecciosas y no infecciosas de las fallas reproductivas.
Dinámica de infección:
Los cerdos se contaminan de la madre cuando son lactantes a partir de secreciones, en esta etapa los anticuerpos maternales pueden proteger a los lechones frente a la infección, estos anticuerpos descienden a las 6-8 semanas de vida y a partir de aquí el virus se replica, se disemina en al animal y es capaz de contagiar a otros animales (4-11 semanas de vida). De esta manera la seroconversión sucede (Segales J. y col., 2019. Lopez-Soria S. y col., 2016) a unas 2-3 semanas post infección. Estos anticuerpos se mantienen elevados hasta la edad de faena o más (28 semanas de vida) (Lopez-Soria S. y col., 2016. Segales J. y col., 2019). El mayor porcentaje de animales infectados y con manifestaciones de PCV2-SD coinciden y se presentan más frecuentemente entre las 8 y las 16 semanas de vida (Lopez-Soria S. y col., 2016. Segales J. y col., 2019).
Los anticuerpos son producidos principalmente contra la proteína de la cápside, que posee poder inmunógeno, pero también contra proteínas no estructurales del virus. (Segales J. y col., 2019).
Herramientas de control:
La llegada de las vacunas contra PCV2 ha marcado un antes y después en la producción porcina de las últimas décadas, con resultados muy espectaculares en la disminución y eliminación de todas las manifestaciones clínicas de PCV2-SD, (Horlen K y vol., 2008), así como la disminución de la viremia y excreción viral (Fort M. y col., 2008, Capuccio J. y col., 2017).
Tanto la vacunación como la infección producen inmunidad humoral y celular. La pobre o nula producción de Ac, que puede observarse luego de la vacunación, no significa una baja protección (Segales J. y col., 2019), existe también una respuesta celular más constante (Fort M. y col., 2009).
La vacunación demostró, en gran cantidad de estudios experimentales y de campo, un aumento de la ganancia diaria, disminución de la mortalidad y de lesiones asociadas a PCV2-SD.
Se han descriptos casos de reagudización o manifestación clínica de PCV2-SD aún en granjas vacunadas. Se interpretó que la vacunación masiva de la mayoría de las granjas con vacunas PCV2a, sería una de las causas de mutaciones virales y falla de cobertura vacunal (Franzo G. y col., 2016). Sin embargo, otros estudios mostraron que el hallazgo de cepas diferentes al PCV2a -como PCV2b y PCV2d- no son originadas por la vacunación masiva con vacunas PCV2a, como utilizada en los primeros tiempos, ni a vacunas PCV2b más modernas utilizadas recientemente. Esta mutación viral sería producida por otros factores aun no identificados (Dvorak M y col., 2017).
Las fallas vacunales descriptas, estarían asociadas a un error en la aplicación, en la interpretación de la situación epidemiológica de la granja, así como la influencia de las co-infecciones y las normas de manejo (Lopez-Soria S. y col., 2016. Segales J. 2017).
Las vacunas comerciales disponibles en la actualidad se basan en diferentes técnicas: 1) Vacunas basadas en antígeno entero PCV2 inactivado, 2) Vacunas basadas en un virus quimera con ORF2 de PCV2 incorporado en PCV1 no-patógeno 3) Vacunas basadas en subunidades, proteína de la cápside (ORF2) de PCV2 expresada en un baculovirus. Estas vacunas poseen hasta el momento los los genotipos a y/o b y/o d (Chae C. 2012).
Los diferentes genotipos reconocidos del PCV2 poseen una similitud en su secuencia de la ORF2 de entre 81-95 %. Se estima que la evolución genómica del PCV2 continuará produciendo diferentes cepas.
Existen una gran cantidad de estudios que demuestran la eficacia del uso de los diferentes tipos de vacunas, ya sean en mono dosis o doble dosis (Changhoon P.y col., 2014; Chamba F. y col., 2020).
Las vacunas fabricadas contra PCV2a y PCV2b protegen en condiciones de campo contra infecciones de diferentes genotipos y especialmente contra el PCV2d de distribución mundial (Opriessnig T.,2016; Chamba F. y col., 2020).
El diseño del programa de vacunación contra PCV2 debe concebirse en cada granja, teniendo en cuenta las características de manejo, las manifestaciones clínicas-epidemiológicas de PCV2 y la incidencia de las enfermedades asociadas (Lopez-Soria S. 2016).
Los programas clásicos de vacunación incluyen a los lechones, si bien los anticuerpos maternales podrían interferir contra la seroconversión activa de los lechones vacunados, esta interferencia no sería suficiente para producir un fallo en la vacunación (Fraile, L, 2013. Segales J. y col., 2019). La vacunación de las madres y cachorras de reposición es de más en más contemplada en los programas actuales, sin embargo, un estudio minucioso de la epidemiologia deber realizarse en cada caso (Segales J. 2017).
La vacunación contra PCV2 sigue siendo una herramienta ineludible en la producción porcina actual, garantizando un mejor status sanitario/bien estar animal y una fuerte reducción del consumo de antibióticos. Su utilización y éxito va en directa asociación con las buenas normas de manejo, medioambientales y de bioseguridad correspondientes a cada granja, promoviendo así una producción sustentable.