AUTORIA: John R. Pluske , a, ∗ Diana L. Turpin , a, b y Jae-Cheol Kim a, c
INTRODUCCION
La salud del tracto gastrointestinal (TGI) («salud intestinal») es un término que se utiliza con mucha frecuencia y es objeto de enorme interés actualmente en todo el mundo, aunque generalmente carece de un significado o etiología preciso y unificador. Varios artículos y revisiones recientes (p. ej., Adewole et al., 2016 , Bischoff, 2011 , Celi et al., 2017 , Jayaraman y Nyachoti, 2017 , Kogut y Arsenault, 2016 , Moeser et al., 2017 , Pluske, 2013 ) han resumió información valiosa y oportuna relacionada con este tema en particular en varias especies diferentes, y no es nuestra intención reiterar todos los detalles incluidos en estas publicaciones. Sin embargo, con respecto a una definición práctica de salud intestinal, Kogut y Arsenault (2016) la definieron como la «ausencia/prevención/evitación de enfermedades para que el animal sea capaz de realizar sus funciones fisiológicas para resistir factores estresantes exógenos y endógenos». Si bien no estamos en desacuerdo con esta interpretación, consideramos que la salud intestinal es más general y puede describirse como una condición generalizada de homeostasis en el TGI, con respecto a su estructura y función generales. De acuerdo con la definición de “salud” de la Organización Mundial de la Salud (OMS) de 1948 (citada por Bischoff, 2011 ), que proponía una definición positiva en lugar de “la ausencia de enfermedades”. Bischoff (2011) comentó que la «salud intestinal» es «un estado de bienestar físico y mental en ausencia de molestias gastrointestinales que requieran la consulta de un médico, en ausencia de indicaciones o riesgos de enfermedad intestinal y en ausencia de enfermedad intestinal confirmada». Esto claramente se refiere a la salud humana; no obstante, Bischoff (2011) argumentó que aunque la OMS definió la salud como algo más que la simple ausencia de enfermedades, la prevención o evitación de las enfermedades del TGI forma una parte integral de nuestra comprensión del problema general.
Estas definiciones generalmente asocian la salud intestinal con patógenos que causan, clínica o subclínicamente, enfermedades, mortalidad y/o morbilidad a los cerdos, y pérdidas económicas posteriores. Sin embargo, y de acuerdo con la definición de Bischoff (2011) , proponemos que la salud intestinal en los cerdos puede verse comprometida incluso en ausencia de enfermedades manifiestas en el TGI. El bajo consumo de alimento después del destete ( Dong y Pluske, 2007 ), por ejemplo, significa una ausencia de nutrición luminal ( Diamond y Karasov, 1983 ), y los factores estresantes y desafíos asociados con el destete también causan cambios en la estructura y función del TGI ( Celi et al., 2017 , Kim et al., 2012 , Jayaraman y Nyachoti, 2017 , Moeser et al., 2017 , Pluske et al., 1997 ). En conjunto, el período inmediatamente posterior al destete en los cerdos no sólo causa marcados cambios estructurales y funcionales en el intestino delgado (por ejemplo, Kelly et al., 1991a , Kelly et al., 1991b , Pluske et al., 1996a , Pluske et al. , 1996b ), sino también contribuye a un estado inflamatorio intestinal que a su vez compromete la arquitectura de las criptas vellosas (p. ej., McCracken et al., 1999 , Spreeuwenberg et al., 2001 , Pié et al., 2004 ), la función de barrera del TGI (p. ej . , Camilleri et al., 2012 , Kim et al., 2012 , Moeser et al., 2017 , Wijtten et al., 2011 ), y alteración de la microbiota (p. ej., Fouhse et al., 2016 , Gresse et al., 2017 , Schachtschneider et al., 2013 ).
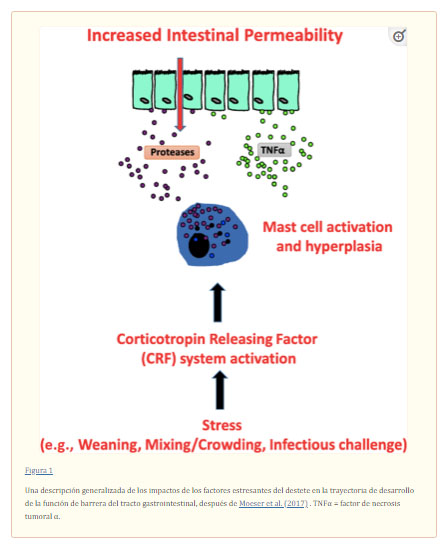
Bischoff (2011) definió además cinco criterios principales que podrían formar la base de una definición general de salud intestinal, siendo estos: 1) digestión y absorción efectiva de los alimentos, 2) ausencia de enfermedades gastrointestinales, 3) microbioma intestinal normal y estable, 4) estado inmunológico efectivo, y 5) estado de bienestar. En general, Celi et al. (2017) señalaron que los componentes clave de la funcionalidad del TGI son la dieta, la estructura y función efectivas de la barrera gastrointestinal, la interacción del huésped con la microbiota gastrointestinal, la digestión y absorción efectiva del alimento y el estado inmunológico efectivo. Sin embargo, y aunque son correctas, las funciones del TGI se extienden más allá de los procesos asociados con procesos como la ingesta de alimento, la digestión y la posterior absorción activa o pasiva y la función de barrera, ya que el TGI desempeña un papel importante en la regulación de las funciones epiteliales e inmunes de importancia vital para el funcionamiento biológico normal y la homeostasis tanto en el TGI como en el cuerpo. La asociación entre el sistema nervioso entérico (SNE) y los centros superiores a través del sistema nervioso parasimpático y (o) el sistema endocrino también juega un papel clave en el bienestar, la salud y la estructura y función del TGI de los animales ( Moeser et al. , 2017 ,Figura 1). Por ejemplo, un estudio en ratones libres de gérmenes informó que el microbioma del TGI influía directamente no solo en las funciones del TGI sino también en el desarrollo del comportamiento y los correspondientes cambios neuroquímicos en el cerebro ( Neufeld et al., 2011 ). Sin embargo, los mecanismos precisos de cómo el microbioma del TGI contribuye a la salud intestinal son menos claros, aunque hay un trabajo reciente considerable que intenta desentrañar dichos mecanismos (p. ej., revisiones de Carabotti et al., 2015 , Foster et al., 2017 ).
-
Mecanismos biológicos subyacentes asociados con un TGI saludable
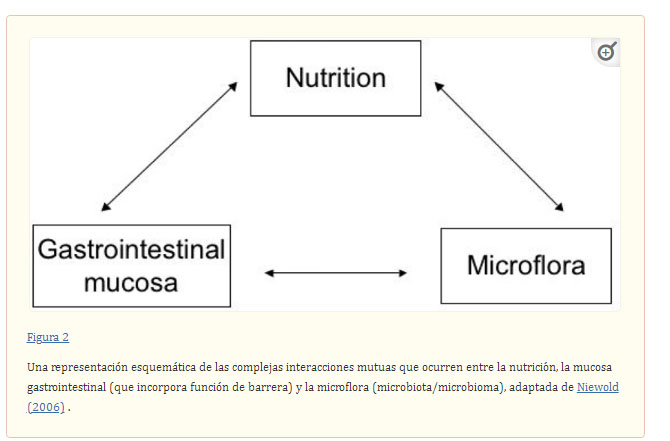
El TGI es un órgano muy complejo, dinámico y en constante cambio; por ejemplo, el TGI de los cerdos jóvenes al destete experimenta cambios rápidos en tamaño, tasas de recambio de proteínas, masa y composición de la microbiota, y alteraciones rápidas y marcadas en las barreras digestivas, de absorción y de absorción. y funciones inmunes (por ejemplo, Boudry et al., 2004 , Cranwell, 1995 , Hampson, 1986a , Hampson, 1986b , Lallès et al., 2004 , Lallès et al., 2007a , Lallès et al., 2007b , Moeser et al. , 2017 , Pluske, 2013 , Pluske, 2016 , Pluske et al., 1996a , Pluske et al., 1996b , Pluske et al., 1997 , Pluske et al., 2003 ). De hecho, las complejas interacciones que ocurren en el TGI entre la nutrición, la mucosa (epitelio) del TGI y la microbiota son claves para impactar la salud intestinal.Figura 2). Si bien se ha realizado una gran cantidad de investigaciones para aumentar nuestra comprensión de los diversos factores e influencias sobre los cambios morfológicos, anatómicos, microbianos, enzimáticos e inmunológicos que ocurren en etapas clave durante el desarrollo, se ha puesto menos énfasis en características más funcionales del TIG con respecto a la salud intestinal (y posiblemente la gestión del TIG en etapas críticas de la vida y/o durante imposiciones críticas de producción) y cómo esto puede verse afectado, por ejemplo, por la nutrición y la alimentación. Bischoff (2011) comentó que las dos principales entidades funcionales clave para lograr un sistema TGI saludable, de acuerdo con los cinco criterios enumerados anteriormente, son la microbiota/microbioma del TGI (p. ej., Frese et al., 2015 , Gaskins, 2001 , Gresse et al ., 2015). al., 2017 ) y la función de la barrera TGI (p. ej., Camilleri et al., 2012 , Moeser et al., 2017 , Wijtten et al., 2011 ) y la interacción entre ambos. Además, también se deben considerar los impactos de la nutrición en estas funciones (Figura 2).
Por supuesto, y en contexto, la atención, comprensión y apreciación de estos dos factores por parte de la industria porcina ha aumentado considerablemente en los últimos 10 a 15 años debido predominantemente a cambios que reducen el uso de antimicrobianos, especialmente antibióticos promotores de crecimiento (AGP; sustancias que afectan el intestino). bacterias y función digestiva que se administran en dosis bajas y subterapéuticas) y (o) minerales pesados, como zinc (ZnO) y cobre (CuSO 4 ). Simplemente está fuera del alcance de esta revisión discutir las diversas cuestiones planteadas a favor y en contra de tales prohibiciones/restricciones sobre AGP y (o) metales pesados, ni discutir los diversos modos de acción supuestos de AGP (véanse revisiones, por ejemplo, de Anderson et al., 1999 , Dibner y Richards, 2005 , Gaskins et al., 2002 , Kil y Stein, 2010 , Thacker, 2013 ), pero simplemente para resaltar que tales cambios han causado un cambio marcado en la naturaleza y el volumen de la investigaciones que se están llevando a cabo relacionadas con la salud intestinal. En este sentido, la discusión relacionada con la microbiota/microbioma, la función de barrera y los sistemas inmunológicos del TGI es muy relevante para este tema.
Existe una amplia gama de productos, como aditivos alimentarios y estrategias de alimentación/manejo disponibles que influyen, o pretenden influir, en diferentes aspectos de la salud intestinal (p. ej., Adewole et al., 2016 , Cheng et al., 2014 , de Lange et al., 2010 , Heo et al., 2013 , Jayaraman y Nyachoti, 2017 , Pluske, 2013 , Pluske et al., 2002 ). La gran cantidad de aditivos para alimentos y (o) agua disponibles para los productores de carne de cerdo para usar como alternativas o reemplazos de los AGP que se han evaluado generalmente tienen como objetivo: 1) mejorar las respuestas inmunes de los cerdos (p. ej., inmunoglobulina, ácidos grasos ω-3 , β-glucanos derivados de levadura), 2) reducir la carga de patógenos en el tracto gastrointestinal del cerdo (p. ej., ácidos orgánicos e inorgánicos, altos niveles de óxido de zinc, aceites esenciales, hierbas y especias, algunos tipos de prebióticos, bacteriófagos, péptidos antimicrobianos) , 3) estimular el establecimiento de microbios gastrointestinales beneficiosos (p. ej., probióticos y algunos tipos de prebióticos) y (o) 4) estimular la función digestiva (p. ej., ácido butírico, ácido glucónico, ácido láctico, glutamina, treonina, cisteína y nucleótidos) ( de Lange et al., 2010 ). Estos productos se caracterizan predominantemente no sólo por sus diferentes modos de acción, sino también por la variación en las respuestas observadas cuando se ofrecen a los cerdos. Esta variación es presumiblemente una consecuencia, en parte, de las diferentes condiciones de manejo en las que se encuentran los cerdos, que a su vez influyen en factores como la composición de la microbiota y la inmunidad de las mucosas. En última instancia, es necesario considerar el costo-beneficio de adoptar tales prácticas para influir en la salud del TGI.
2.1. Microbiota/microbioma del tracto gastrointestinal: implicaciones para la salud intestinal
No es nuestra intención describir las características generalizadas de la microbiota del TGI porque han sido descritas adecuadamente en numerosos artículos y artículos de revisión. Sin embargo, es evidente que una gran cantidad de factores influyen en la diversidad y actividad de la microbiota del TGI, incluida la colonización y la sucesión asociada de poblaciones microbianas, la edad del cerdo y el entorno en el que habita, los agentes antimicrobianos, la composición de la dieta, los aditivos alimentarios y el procesamiento de los piensos. , métodos de alimentación, carga de enfermedades, destete, estación, ambiente, estrés y genética. Además, la microbiota intestinal (o microbioma, que representa la información genómica de la microbiota) representa un compromiso entre la útil funcionalidad de la barrera, la síntesis de nutrientes y proteínas beneficiosos y una mejor recolección de energía a partir de componentes dietéticos con bajo potencial inherente, y los efectos nocivos de la inflamación y patologías subclínicas (y clínicas) ( Celi et al., 2017 ).
Como era de esperar, existe un conjunto variado de bacterias que divergen en densidad y diversidad de población en diferentes compartimentos del TGI y en diferentes etapas de la vida de un cerdo ( Holman et al., 2017 , Leser et al., 2002 , Richards et al. ., 2005 , Zhao et al., 2015 ). Además, la microbiota está íntimamente involucrada en la comunicación cruzada entre las bacterias entéricas y el huésped, y la química y la distribución de los sitios de unión bacteriana en las superficies de la mucosa intestinal desempeñan un papel clave en la determinación de la susceptibilidad del huésped y del tejido y en el desencadenamiento de respuestas del huésped, especialmente en animales jóvenes. (p. ej., Kelly y King, 2001 , Montagne et al., 2003 , Celi et al., 2017 ). Parte del debate con respecto a la microbiota y la salud intestinal se centra de manera simplista en las bacterias «buenas» versus las «malas» y su impacto en la estructura y función del TGI; sin embargo, Hillman (2004) propuso ese énfasis en relación con la composición y diversidad del TGI. La microbiota debe ubicarse en una microbiota óptima presente en el TGI en lugar de una microbiota normal, porque los comensales y los patógenos coexisten normalmente, incluso en ausencia de una enfermedad manifiesta, durante gran parte de la vida productiva de un cerdo. Por lo tanto, la presencia o ausencia de un organismo patógeno no necesariamente puede predecir que se producirá una enfermedad a menos que su número prolifere hasta tal punto que abrume a la población microbiana general en el TGI, o más específicamente en una región específica del TGI ( Hopwood et al., 2005 ). Esto variará según los sitios de producción (p. ej., sitios interiores o exteriores; Schmidt et al., 2011 ), genética, dietas, etc. A este respecto, Hillman (2001) demostró que los lactobacilos que tienen actividad antipatogénica contra la patógena F4 Escherichia coli se distribuyeron de manera desigual en 19 granjas porcinas escocesas, lo que probablemente explica las variaciones observadas en la eficacia de los probióticos y otros aditivos. La adición de un antimicrobiano al TGI donde hay una población de bacterias que ya poseen una alta actividad antimicrobiana local probablemente sea menos efectiva que agregarlo donde hay una población que muestra poca o ninguna actividad antimicrobiana preexistente ( Hillman, 2001).). En la actualidad, no se comprende bien con respecto a la gran mayoría de la población, la consistencia de la actividad (p. ej., entre granjas, entre dietas y entre estaciones), en lugar del grado de actividad de aditivos alimentarios seleccionados que modulan las bacterias del TGI, que a su vez pueden afectar la salud intestinal. número de reemplazos/alternativas de antibióticos en el mercado actualmente. Podría decirse que, en este sentido, la salud intestinal debería centrarse en ayudar al animal a regular los cambios en el microbioma intestinal de manera que se eviten cambios rápidos de población y se pueda mantener el equilibrio.
2.2. Alteraciones de la microbiota intestinal y diarrea post-destete
Cualquier discusión sobre la salud intestinal en el período post-destete debe incluir los impactos potenciales de las cepas (serotipos) de E. coli enterotoxigénica (ETEC) asociadas con infecciones y enfermedades, es decir, colibacilosis post-destete (o diarrea post-destete; PWD) ( ej., Fairbrother et al., 2005 , Francis, 2002 , Lallès et al., 2007b , Pluske et al., 2002 ), y los medios para prevenirlo o controlarlo. Entre los factores fisiológicos y del TGI afectados por la transición al destete, la alteración de la microbiota en el TGI es probablemente una influencia clave que conduce a la PWD. La mayoría de los estudios realizados durante la transición al destete han reportado una disminución de bacterias del género Lactobacillus spp. grupo y una pérdida de diversidad microbiana, mientras que Clostridium spp., Prevotella spp. o anaerobios facultativos como Proteobacteriaceae , incluida E. coli , se vieron afectados positivamente ( Gresse et al., 2017 ). Sin lugar a dudas, el cambio de los lechones desde la leche de cerda a una dieta sólida de diferente composición y forma juega un papel importante en la predisposición a la diarrea tras el destete, tanto de origen microbiano como dietético. Además, los antibióticos en el alimento y (o) en el agua también causan diferencias en la microbiota del TGI al destete debido a su amplio espectro de actividad y, por lo tanto, a su capacidad potencial para matar o prevenir el crecimiento de microbios tanto patógenos como beneficiosos ( Gresse et al. ., 2017 ). La diversidad de la microbiota puede disminuir aún más ( Looft et al., 2012 ) con el uso extendido de AGP, lo que puede aumentar las oportunidades para que los microorganismos patógenos colonicen y desencadenen enfermedades ( Fouhse et al., 2016 ). En este sentido, la resistencia a los antimicrobianos también es clave para cualquier debate relacionado con el uso de antibióticos.
En consecuencia, el destete en condiciones comerciales se ha asociado con un estado alterado de la microbiota o una disbiosis ( Lallès et al., 2007a ). Sin embargo, las características subyacentes precisas que permiten predecir tal estado no están completamente claras. Sin embargo, un trabajo reciente de Dou et al. (2017) evaluaron si la diversidad y composición de la comunidad bacteriana del TGI durante el período de lactancia se asociaban con diferencias en la susceptibilidad de los cerdos a la PWD. Utilizando una caracterización molecular de la microbiota fecal con huellas dactilares CE-SSCP, secuenciación de próxima generación y qPCR, Dou et al. (2017) demostraron que los cerdos diarreicos y sanos, es decir, con respecto a tener PWD o no, fueron discriminados principalmente ya en el día 7 posnatal, es decir, 4 semanas antes de la aparición de PWD. En el día 7 postnatal, los cerdos sanos (sin PWD) mostraron una menor uniformidad y una mayor abundancia de Prevotellaceae , Lachnospiraceae , Ruminocacaceae y Lactobacillaceae en comparación con los cerdos diarreicos (después del destete). Los análisis de regresión indicaron que estas familias de bacterias estaban fuertemente correlacionadas con una mayor abundancia de Bacteroidetes observada en los cerdos sanos (sin PWD) 1 semana antes de que ocurriera la diarrea. Estos autores enfatizaron el potencial de la diversidad y composición temprana de la microbiota, durante la lactancia, como indicador de susceptibilidad a las PWD.
Como se mencionó anteriormente, una característica del TGI después del destete es una respuesta inflamatoria. Zeng et al. (2017) señalaron que las perturbaciones de la microbiota se observan comúnmente en enfermedades que involucran inflamación en el TGI, siendo el microambiente inflamado particularmente propicio para el crecimiento excesivo de enterobacterias , que adquieren beneficios de aptitud física mientras que otras familias de bacterias simbióticas sucumben a los cambios ambientales infligidos por la inflamación. Los mecanismos de respuesta inflamatoria del huésped del tracto gastrointestinal producen especies reactivas como el óxido nítrico que, cuando se libera en la luz del TGI, se transforma rápidamente en nitrato. Este entorno rico en nitratos confiere ventajas de crecimiento a algunas cepas de E. coli , que poseen genes de nitrato reductasa que están ausentes en especies de Clostridia o Bacteroidia ( Gresse et al., 2017 ). Un estudio reciente de Wei et al. (2017) informaron un aumento de la concentración de especies reactivas de oxígeno en el intestino junto con una expansión de la población de E. coli 7 días después del destete. En consecuencia, existe mucho interés en el uso de la evaluación del estado de los antioxidantes ( Buchet et al., 2017 ) y compuestos ( Zhu et al., 2012 ) para mitigar este aspecto de la salud intestinal.
-
Función de barrera y aspectos inmunológicos de la mucosa del TGI
Una cuestión integral cuando se habla de salud intestinal, interconectada con los efectos de la microbiota/microbioma y el huésped, es la de la función de la barrera epitelial y el sistema inmunológico de las mucosas ( Burkey et al., 2009 , Pluske et al., 2018 ). El sistema inmunológico de la mucosa se ve desafiado continuamente por factores externos (p. ej., dieta, aerosoles) e internos (p. ej., la microbiota), de ahí numerosos tipos de células como células dendríticas, linfocitos (sistema inmunológico adaptativo), macrófagos y citocinas (sistema inmunológico innato). han evolucionado para desempeñar funciones importantes en la regulación de la comunicación entre el microbioma del TGI y su sistema inmunológico de la mucosa. Como lo describen Moeser et al. (2017) , las células epiteliales intestinales actúan como células centinelas inmunes al reconocer moléculas de señal patógenas y secretar interleucinas (IL) y factores de crecimiento (p. ej., IL-17A, IL-33, IL-23 y factor de crecimiento transformante-β), que Tienen importantes propiedades inmunomoduladoras. Las células inmunitarias residentes y el tejido linfoide asociado al intestino constituyen el órgano inmunitario más grande del cuerpo. Dado el entorno luminal antigénico masivo y la exposición continua a productos luminales, el sistema inmunológico del TGI está estrechamente regulado a través de una serie de mecanismos moleculares, para prevenir una activación excesiva y una inflamación en respuesta a estos factores. Por el contrario, el sistema inmunológico del TGI también debe responder rápida y fuertemente a cualquier violación en la función de barrera o en caso de un desafío patógeno/antigénico, para movilizar respuestas inmunes innatas y adaptativas, lo cual es crítico para prevenir la propagación sistémica de infecciones e inflamación. Moeser et al., 2017 , Pluske et al., 2018 ).
Como se mencionó anteriormente, la función de la barrera epitelial se ve comprometida en el período inmediatamente posterior al destete, donde el destete provoca un intestino delgado más permeable (p. ej., Spreeuwenberg et al., 2001 ; Moeser et al., 2007 ; Pohl et al., 2017 ). . La inflamación del intestino se asocia con un aumento de la permeabilidad que puede provocar la translocación de toxinas, alérgenos, virus o incluso bacterias. Cuando las bacterias cruzan esta primera línea de defensa y alcanzan la lámina propia, sus metabolitos o mediadores liberados de las células epiteliales pueden provocar una respuesta inflamatoria y, en este caso, la medición de las citocinas proinflamatorias proporciona cierta información sobre el grado de inflamación local. inflamación ( Johnson, 1997 ). Por lo tanto, el destete per se , y esencialmente el período de anorexia que ocurre inmediatamente después del destete, causa una respuesta inflamatoria (p. ej., McCracken et al., 1999 , Pié et al., 2004 ) que inicia perturbaciones en la salud intestinal; en este caso, simplemente alentar a los cerdos a comer más alimento después del destete ayuda a mejorar estas respuestas ( Pluske et al., 1997 ).
Moeser et al. (2017) han proporcionado una revisión exhaustiva de las interacciones y asociaciones entre el estrés del destete y el desarrollo y función de la barrera del TGI, con una discusión sobre las implicaciones para la salud intestinal de por vida en los cerdos. Una vez más, no es nuestra intención reexaminar esto, sino reiterar que los factores estresantes en las primeras etapas de la vida, como el destete, alteran la trayectoria de desarrollo de las funciones de barrera del TGI, lo que puede tener consecuencias nocivas duraderas para la salud intestinal, la susceptibilidad a las enfermedades y las consecuencias productivas. Como concluyeron Moeser et al. (2017) , el concepto de los orígenes tempranos de la susceptibilidad a la enfermedad del TGI en el cerdo está respaldado por paradigmas en humanos donde los eventos adversos en la vida temprana (p. ej., trauma psicológico, inflamación, infección) son factores de riesgo para enfermedades inflamatorias y funcionales del TGI más adelante en la vida. . Se necesita una mayor comprensión y apreciación de cómo los factores estresantes y los desafíos de la vida temprana, como el destete, el moho, las funciones epiteliales, inmunes y del ENS a largo plazo, son necesarios para descubrir nuevos objetivos y (o) intervenciones de manejo para promover el desarrollo óptimo del TGI y a largo plazo. salud intestinal. En este sentido, productos como el cromolín, un agente estabilizador de los mastocitos, pueden impartir beneficios para mejorar la función de barrera y el rendimiento en el período posterior al destete ( Mereu et al., 2015 ,tabla 1).

-
Impactos de la nutrición y el manejo previo y posterior al destete en la salud intestinal después del destete
Existe una gran cantidad de estudios y revisiones sobre el manejo nutricional y el control del TGI para influir en la salud intestinal, incluso en ausencia de enfermedades entéricas manifiestas, y no repetiremos los principales resultados de esos estudios en esta revisión. Sin embargo, sería negligente no reiterar las conclusiones de Jayaraman y Nyachoti (2017) en el sentido de que las prácticas de cría relacionadas con la alimentación y la nutrición, el bienestar animal, la bioseguridad y la prevención de enfermedades son determinantes importantes de la salud intestinal y el rendimiento de los lechones, por lo que la adopción posterior de medidas de cría estrictas prácticas es fundamental en la implementación de estrategias dirigidas a la cría de cerdos en ambientes con uso reducido de antibióticos, o sin el uso de AGP y (o) minerales como Zn y Cu. La siguiente discusión comienza con un examen de la alimentación suplementaria y las estrategias de manejo previo al destete como posibles agentes para influir en la salud intestinal después del destete, y concluye con una sección relacionada con aspectos de una dieta administrada después del destete que podrían considerarse en el contexto de mejorar la salud intestinal. salud.
4.1. Alimentación suplementaria de lechones en lactación para mejorar la salud intestinal tras el destete
La alimentación progresiva es una práctica establecida desde hace mucho tiempo que consiste en ofrecer una dieta sólida (un alimento ‘creep’) a los lechones mientras aún están mamando a la cerda. Tradicionalmente, este alimento se presentaba en un área separada (el ‘creep’) de la paridera para evitar que la madre tuviera acceso al alimento; sin embargo, ahora el término se usa simplemente para el alimento ofrecido a los lechones en lactancia ( inglés). , 1981 ). Proporcionar dietas secas (creep) a los lechones en lactancia presenta oportunidades para mejorar el peso al destete y el rendimiento de los cerdos después del destete, aparentemente a través de la estimulación de las enzimas digestivas asociadas con la digestión de carbohidratos y proteínas, y (o) la tolerancia a los antígenos presentes en las dietas alimentadas después. destete. Se ha propuesto que la alimentación progresiva se vuelve más importante y beneficiosa a medida que aumenta la edad al destete, porque a medida que los lechones crecen, su demanda de nutrientes crece de manera similar y con el aumento de la edad esta demanda supera la capacidad de la cerda para suministrarlos, a medida que la producción de leche de la cerda alcanza su punto máximo. alrededor de las 3 semanas y luego disminuye lentamente ( Pluske et al., 1995 ). Inglés y otros. (1980) sugirieron que un lechón debería consumir, en promedio, 600 g de pienso antes del destete para estar preparado para el proceso y mitigar el control del crecimiento post-destete. A las edades actuales de destete, este nivel de ingesta individual es inalcanzable.
Por lo tanto, no es sorprendente que esta área de alimentación y manejo haya atraído una gran cantidad de investigación y desarrollo dados sus impactos potenciales en la estructura y función del TGI post-destete y, por lo tanto, en el rendimiento. Sin embargo, la evidencia que respalda la idea de que la alimentación progresiva durante la lactancia prepara el TGI para los desafíos posteriores al destete es equívoca. Chapple et al. (1989) informaron que la variación en la actividad amilolítica en el páncreas de los lechones era más función de la cerda (camada de origen) que de la ingesta de alimento sólido durante la lactancia e inmediatamente después del destete. De manera similar, Lindemann et al. (1986) y de Passille et al. (1989) encontraron que las actividades de pepsina y maltasa en el TGI no podían estar relacionadas con el peso al destete ni con la duración de la alimentación progresiva durante la lactancia. Bruininx et al. (2004) informaron la falta de asociación entre el consumo de pienso antes del destete y la estructura intestinal 5 días después del destete. Una razón probable para estos hallazgos es la cantidad generalmente baja de materia seca que consumen los lechones mientras maman a la cerda ( Brooks y Tsourgiannis, 2003 , King y Pluske, 2003 , Pluske et al., 1995 ).
Sin embargo, los estudios en los que se clasificó a los lechones en consumidores y no consumidores de alimento para animales han proporcionado algunos conocimientos nuevos sobre el valor del alimento para animales después del destete (p. ej., Bruininx et al., 2002 , Pluske et al., 2007 , Sulabo et al. ., 2010 ). Estos estudios han demostrado en general que sólo una cierta proporción de cerdos (alrededor del 45% al 65%) dentro de la camada consumen piensos avanzados y que los consumidores (es decir, los lechones de la camada que consumieron piensos avanzados positivamente) tienen mejores comportamientos exploratorios iniciales post-destete. , consumo de alimento y rendimiento de crecimiento que los que no comieron (es decir, lechones que no consumieron alimento artificial). Aumentar la proporción de cerdos individuales que consumen piensos de cría dentro de las camadas puede provocar efectos positivos en el rendimiento de la cría. Por lo tanto, es importante identificar los factores que pueden hacer que haya más consumidores de pienso en camadas enteras. Sin embargo, Carstensen et al. (2005) informaron que la función intestinal asociada con un contacto voluntario con alimento de baja fluencia durante el período de lactancia condujo a una disminución del consumo de alimento justo después del destete y, a su vez, redujo la proliferación intestinal de E. coli O149 en estos lechones.
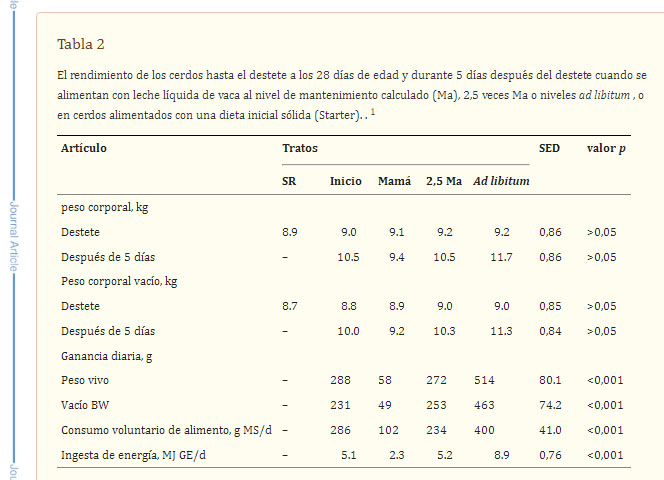
A pesar de la falta general de asociaciones positivas entre el alimento lento (sólido), el peso al destete y la salud intestinal después del destete, existe buena evidencia de que proporcionar alimento suplementario en forma líquida o papilla antes y (o) después del destete aumenta la ingesta de materia seca durante la lactancia (p. ej. , revisiones de King y Pluske, 2003 , Pluske et al., 1995 , Pluske et al., 2005 ), aumenta el peso al destete y puede reducir la gravedad del control del crecimiento después del destete. Los estudios de Pluske et al. (1997) demostraron claramente que aspectos de la estructura y función del TGI se podían mantener en el período inmediatamente posterior al destete ofreciendo dietas líquidas lácteas a los cerdos recién destetados, proporcionales con una pequeña desviación en la arquitectura y función de las vellosidades y criptas en comparación con sus contrapartes de cerdas amamantadas. . Sin embargo, los cerdos a los que se les ofreció una dieta sólida de destete con el mismo nivel de ingesta que los cerdos a los que se les ofreció una dieta líquida de leche mostraron atrofia de la estructura epitelial. Estos cambios pueden verse como un compromiso de la salud intestinal en estos cerdos; sin embargo, a pesar de estos cambios morfológicos, el rendimiento de los cerdos al mismo nivel de ingesta de materia seca fue en su mayoría similar (Tabla 2). Estos datos resaltan parte de la ambigüedad en las discusiones sobre la salud intestinal, es decir, los cerdos crecieron muy bien después del destete, los aspectos estructurales y funcionales de su TGI se vieron afectados negativamente. Además, y en ausencia de enfermedades intestinales en estos cerdos, estos datos refuerzan la necesidad de definir el contexto de cualquier discusión relacionada con el tema.
4.2. Enfoques de gestión
Un enfoque alternativo o complementario para mejorar el tiempo de adaptación al destete, con posibles impactos en la salud intestinal, es imitar los procesos de destete gradual que ocurren en los cerdos en su entorno natural. Esto puede abordar las necesidades de los lechones de tal manera que genere beneficios a largo plazo con respecto al rendimiento y el bienestar. En la naturaleza, una cerda se aislará antes del parto y regresará al grupo para permitir que su camada se mezcle con otros lechones aproximadamente 10 días después del nacimiento ( Jensen, 1986 ). No hay un punto particular en el que la cerda comienza a destetar a sus crías, ya que es un proceso gradual que ocurre durante 13 a 19 semanas, en el que la cerda controla predominantemente el inicio y la terminación de los episodios de lactancia ( Jensen, 1988 , Jensen y Recén, 1989 ). . A medida que los beneficios de la lactancia comienzan a disminuir para los lechones (es decir, demasiado gasto de energía por una recompensa insuficiente), la ingesta de alimento sólido de los lechones procedente de la exploración del entorno comienza a aumentar ( Bøe, 1991 ). Curiosamente, no hay disminución en el aumento de peso diario durante el destete en condiciones naturales ( Bøe, 1991 ).
Un sistema de alojamiento de lactancia, donde una cerda puede dejar a sus lechones a voluntad pasando una barrera, ofrece una opción para que la cerda destete gradualmente a sus lechones en un entorno comercial. En tales sistemas, las cerdas generalmente eligen pasar menos tiempo con su camada al final de la lactación, lo que resulta en un aumento en el consumo de pienso por parte de los lechones en comparación con los lechones alojados convencionalmente ( Pajor et al., 2002 , Rantzer et al., 1995a , Weary et al., 2002 ). Sin embargo, este efecto suele ir acompañado de una disminución en la tasa de crecimiento, lo que sugiere que el aumento en el consumo de pienso no es suficiente para compensar la pérdida de consumo de leche como resultado de que la cerda pasa menos tiempo con los lechones ( Pajor et al., 2002 , Pluske et al., 1995 , Rantzer et al., 1995a , Weary et al., 2002 ). Además de esto, las mejoras en el rendimiento post-destete varían y algunos estudios informan que son inmediatas (es decir, 24 h después del destete; Pajor et al., 2002 ) o a corto plazo (es decir, dentro de la primera semana después del destete; Pajor et al., 1999 , Weary et al., 2002 ) mejoras en el aumento de peso y el consumo de alimento, que contrastan con los resultados de Rantzer et al. (1995a) , donde no se informaron diferencias entre los grupos de tratamiento en cuanto al rendimiento post-destete. Sin embargo, no se informaron datos relacionados con los índices de salud intestinal. Curiosamente, los sistemas de lactancia grupal, en los que las cerdas tienen libertad para pasar menos tiempo con los lechones y oportunidad para que los lechones socialicen con personas que no son de camada antes del destete, parecen tener mejoras más duraderas en el rendimiento con mayores ganancias de peso en los cerdos expuestos a lactancia grupal. la lactancia se informó hasta 5 semanas después del destete, en comparación con los cerdos alojados convencionalmente ( Kutzer et al., 2009 , van Nieuwamerongen et al., 2015 , van Nieuwamerongen et al., 2017 ). A pesar de los diferentes beneficios de producción asociados con el alojamiento controlado por cerdas, existe el riesgo de que la variación en la cantidad de tiempo que las cerdas eligen pasar con sus lechones pueda resultar en que el sistema no se beneficie en absoluto ( Pitts et al., 2002 ).
Las actitudes y el comportamiento de las cerdas varían desde aquellas que pasan casi todo su tiempo alejadas de la camada (especialmente hacia el final de la lactancia) hasta aquellas que rara vez abandonan el área del nido ( Bøe, 1991 , Pajor et al., 1999 , Pajor et al. ., 2000 , Pajor et al., 2002 , Rantzer et al., 1995b ). Los resultados de Pajor et al. (1999) ilustraron una tendencia general de aumento de peso post-destete y consumo de alimentos de camadas de “abandonas tempranas” (cerdas que pasaron más del 60% de su tiempo alejadas de la camada en la tercera semana de lactancia) a ser mayor que aquellos de los lechones que abandonaron tarde, sin embargo, esto a menudo compensaba una depresión en el aumento de peso de los lechones durante la lactancia. Además, desde un punto de vista conductual, los cerdos de «abandonos tempranos» manipularon a sus compañeros de corral con más frecuencia que los cerdos de cerdas alojadas convencionalmente o de los «abandonos tardíos» ( Pajor et al., 1999 ), posiblemente debido a una falta de atención materna. atención, pero esto se contradice con Pitts et al. (2002), quienes observaron que las cerdas que utilizaban más la zona de escape del corral respondían con más fuerza a los estímulos relacionados con la necesidad de los lechones. Sin embargo, se ha demostrado que la variabilidad en la cantidad de cerdas que utilizan su área libre de lechones debilita los beneficios del alojamiento controlado para cerdas, lo que ha impulsado la investigación de sistemas de alojamiento que permitan un uso más frecuente y consistente de un área de escape para las cerdas. Esto, a su vez, puede permitir que una mayor ingesta de alimento antes del destete afecte la estructura y función del TGI después del destete.
Similar en concepto al alojamiento controlado de cerdas, la lactancia intermitente (IS) implica la separación diaria de cerdas y lechones durante un período de tiempo específico durante la última parte de la lactancia. Tradicionalmente se ha examinado el potencial de los regímenes de lactancia intermitente para inducir un estro durante la lactancia, lo que permite un posible apareamiento ( Downing, 2015 , Gerritsen et al., 2008 ); -rendimiento al destete ( Berkeveld et al., 2009 , Kuller et al., 2004 , Kuller et al., 2007b , Turpin et al., 2017a , Turpin et al., 2017b ) y comportamiento ( de Ruyter et al., 2017 ) . Por el contrario, existe la preocupación de que los episodios repetidos y forzados de separación de cerdas y lechones sean perjudiciales para el bienestar de los lechones y de las cerdas, con posibles implicaciones para la salud intestinal post-destete. Sin embargo, los estudios fisiológicos y de comportamiento que han examinado esto más a fondo solo han informado un aumento transitorio en el cortisol de los lechones ( Downing, 2015 , Turpin et al., 2016a ) y la actividad ( Berkeveld et al., 2007a ; Turpin, 2017 ) en los primeros 1 a 2 días de separación, después de lo cual los niveles se estabilizan al valor inicial o a los mismos niveles que sus contrapartes destetados convencionalmente. Turpin (2017) no informó ningún efecto adverso de este aumento en aspectos de la salud intestinal (degradación de los mastocitos, densidad del receptor CRF-1) después del destete, a diferencia de otros informes relacionados con el estrés del destete (ver Moeser et al., 2017 ). . Una diferencia en la edad de destete en estos estudios (16 a 18 días) que en el estudio anterior (>24 días de edad) puede haber sido responsable de esta diferencia. Además, no se han informado patrones de comportamiento que indiquen angustia de los lechones durante la IS ( Berkeveld et al., 2007a ; Kearns et al., 2011 ; Turpin et al., 2017a , Turpin et al., 2017b ).
Sin embargo, al igual que en el alojamiento controlado por cerdas, los estudios de IS a menudo documentan un control inicial del crecimiento al inicio del IS durante la lactancia debido a una menor ingesta de leche debido a la reducción de las oportunidades de amamantar ( Berkeveld et al., 2009 , Kuller et al., 2004 , Kuller et al., 2007a , Thompson et al., 1981 ). Este control del crecimiento es generalmente menor que el observado después del destete convencional y se compensa durante la primera semana después del destete con mayores consumos de alimento y ganancias de peso en comparación con los cerdos destetados abruptamente ( Berkeveld et al., 2007b , Berkeveld et al., 2009 , Kuller et al., 2004 , Kuller et al., 2007b , Turpin et al., 2016b ). En este sentido, se podría postular que tener un período de crecimiento reducido cuando el lechón todavía está respaldado por anticuerpos maternos, factores de crecimiento y hormonas en la leche ( Cera et al., 1987 ) en lugar de después del destete, cuando la síntesis de anticuerpos y la inmunidad celular se reducen ( Blecha y Kelley, 1981 , Blecha et al., 1983 ), es más ventajoso, especialmente con respecto al riesgo de enfermedad. Esto se ve respaldado por el hecho de que el IS puede prevenir la atrofia de las vellosidades asociada al destete en el período inmediatamente posterior al destete ( Berkeveld et al., 2009 , Nabuurs et al., 1996 ). Sin embargo, al utilizar pruebas de absorción de azúcar para evaluar in vivo la capacidad de absorción general del intestino delgado, Turpin (2017) no encontró mejoras antes y después del destete cuando los cerdos fueron sometidos a IS durante 16 u 8 h (Fig. 3). Sin embargo, la excepción con el IS parece ser en las camadas primíparas donde las mejoras en el crecimiento, el consumo de alimento y la morfología del TGI han sido modestas ( Turpin et al., 2016a , Turpin et al., 2017b ) o ausentes ( Turpin et al., 2016b ). ), probablemente debido a una menor producción de calostro y leche por parte de las cerdas primíparas y, por tanto, un menor consumo de leche por parte de los lechones. Esto se ve agravado por una mayor reducción del consumo cuando se produce la separación.
Concentración de manitol en plasma (A) y concentración de galactosa en plasma (B) en cerdos de control (barra negra), lechones que se sometieron a lactancia intermitente (IS; separados de la cerda en lactancia) durante 16 h (IS16; barra de franja negra) y lechones que se sometió a IS durante 8 h (IS8; barra gris), cuando se le practicó la eutanasia ya sea al destete (d 0) o 4 días después del destete (d 4). *** indica un efecto significativo ( P < 0,01) del día. Adaptado de Turpin (2017) .
En conjunto, los estudios que examinan los regímenes de IS sugieren que la combinación de IS con una duración prolongada de la lactancia (33 a 45 días) elimina el control del crecimiento post-destete y la atrofia de las vellosidades tanto en primíparas ( Turpin et al., 2016b ) como en multíparas ( Berkeveld et al., 2007b , Berkeveld et al., 2009 ) progenie. Como se analizó anteriormente, muchos estudios (sin IS) han informado un bajo consumo de pienso en las primeras 3 semanas de edad, seguido de un marcado aumento en la cuarta y quinta semana de edad ( Pajor et al., 1991 , Pluske et al., 2007). , Puppe y Tuchscherer, 2000 ). Por lo tanto, retrasar el IS y el destete presumiblemente da a los lechones más tiempo para familiarizarse con el alimento sólido y el TGI se adapta mejor a la digestión y absorción de nutrientes ( Pluske et al., 2003 ), lo que provoca una mejora en la «salud intestinal».
4.3. Formulación de una dieta comercial después del destete para una salud intestinal óptima
Para completar esta revisión, hemos intentado definir los aspectos de una dieta para un cerdo recién destetado que deben considerarse para una salud intestinal óptima, con las referencias apropiadas. A la luz de la gran cantidad de literatura pasada y presente y con la vista puesta en la práctica comercial y la realidad, y en ausencia de AGP, una dieta para mejorar la salud intestinal en el período posterior al destete puede incorporar (pero no limitarse a) los siguientes características:
-
1)Manejo de proteínas/aminoácidos
-
a)Reducir el contenido de proteínas tanto como sea posible (hasta el nivel que no comprometa el menor costo y rendimiento), equilibrar con aminoácidos esenciales y utilizar una fuente o fuentes de proteínas altamente digeribles inmediatamente después del destete (p. ej., Heo et al., 2013). ).
-
b)Considere el uso de superdosis de fitasa y xilanasa para mejorar la digestibilidad de las proteínas (p. ej., Cowieson et al., 2017 ).
-
C)Aumentar la proporción de aminoácidos de azufre a lisina a 60 % a 65 %, la proporción de Trp a Lys a 21 % a 22 % y la proporción de Thr a Lys a 70 % (p. ej., Capozzalo et al., 2017 , Goodband et al. , 2014 ).
-
d)Maximice la proporción de Trp a aminoácidos neutros grandes para aumentar los niveles de serotonina (p. ej., Shen et al., 2012 , Sterndale et al., 2017 ).
-
mi)Cuando corresponda, utilizar una fuente de proteína plasmática (p. ej., Crenshaw et al., 2017 , Pérez-Bosque et al., 2016 ).
-
-
2)Manejo de carbohidratos
-
a)Minimice la inclusión de polisacáridos solubles sin almidón (NSP), utilice una fuente de almidón procesado y, si es posible, muela los granos de manera más gruesa en lugar de más fina (p. ej., Flis et al., 2017 , Jha y Berrocoso, 2015 ).
-
b)Incluir una fuente (o fuentes) de NSP insolubles (p. ej., salvado de trigo, cáscaras de avena, cáscaras de cebada, lignocelulosa) (p. ej., Flis et al., 2017 , Jha y Berrocoso, 2016 , Molist et al., 2016 ).
-
C)Utilice carbohidrasas (xilanasa, β-glucanasa), cuando corresponda, para aumentar la disponibilidad in vivo de oligosacáridos de cadena corta ( Bedford y Walk, 2017 ).
-
-
3)Manejo de grasas/ácidos grasos
-
a)Minimizar la proporción de AGPI n-6 a n-3, dentro del nivel que no comprometa el costo de la dieta (p. ej., Shin et al., 2017 ).
-
b)
-
-
4)Manejo de minerales
-
a)Reducir los niveles de Ca entre un 10% y un 20% (para reducir la capacidad amortiguadora en el estómago y asegurar la actividad de las enzimas endógenas (pepsina) y exógenas (fitasa) ( Stein, 2007 ).
-
b)Utilice niveles farmacológicos de Zn y (o) Cu si está permitido y cuando sea apropiado (p. ej., Pluske, 2013 ).
-
-
5)Complementar de 150 a 200 UI de vitamina E y otros antioxidantes (p. ej., aceites esenciales y fitógenos con capacidad antioxidante; Kim et al., 2016 ).
-
6)Considere otros aditivos que tendrán impacto en la mitigación de la inflamación y la función inmune (p. ej., revisión de Brufau et al., 2015 ), como la aspirina ( Kim et al., 2016 ).
5. Conclusiones
El estado comprometido del cerdo joven después del destete lo convierte en un candidato ideal para una variedad de intervenciones dietéticas y/o de manejo que podrían influir beneficiosamente en la salud intestinal, especialmente en una era de uso reducido/prohibido de AGP y/o metales pesados. Se han logrado avances importantes en un período de tiempo relativamente corto en relación con nuestra comprensión en este campo, con referencia a los mecanismos que sustentan la fisiología y la morfología, la microbiota/microbioma y el sistema inmunológico localizado, y luego, a su vez, sus interacciones con la nutrición y gestión. En este sentido, los criterios (o índices) generalizados para la evaluación de la salud intestinal en cerdos jóvenes podrían incluir: 1) digestión y absorción efectiva de los alimentos y excreción de desechos), 2) una barrera intestinal funcional y protectora, 3) una barrera intestinal estable y protectora. población microbiana adecuada, 4) funcionamiento eficaz del sistema inmunológico intestinal, 5) activación/estimulación mínima del estrés/vías neuronales, y 6) ausencia de enfermedad(es). En conjunto, estos deberían permitir un funcionamiento óptimo del GIT al mismo tiempo que un rendimiento de producción óptimo. Sin embargo, y de manera algo ambigua, algunos estudios relacionados con la salud intestinal han examinado cambios en estos criterios (índices) en ausencia de cualquier enfermedad manifiesta; esto hace que las recomendaciones generales (p. ej., dietéticas, de manejo) sean más difíciles. Sin embargo, han surgido algunos conceptos para mejorar la salud intestinal en cerdos post-destetados, por ejemplo, la noción de estimular/anular grupos específicos de bacterias en el TGI para modificar el entorno del TGI, preservar la función de barrera epitelial, manipular la composición de la dieta (p. ej., tipo y nivel de proteína) y atención cuidadosa a los procedimientos de manejo. En un contexto más general, la salud intestinal representa los resultados del TGI en respuesta a su capacidad y habilidad para responder y adaptarse a los insultos y desafíos que encuentra en sus intentos de mantener la homeostasis.